Optisch sauber: Klarheit für regulatorische Richtlinien
Von Thomas Altmann, Global CIP/COP Technical Manager Cleaning Validation

„Optisch sauber“ wird als Begriff in fast allen Pharmabestimmungen (FDA, PIC/S, GMP) verwendet. Einfach ausgedrückt, müssen die in der pharmazeutischen Herstellung verwendeten Geräte vor ihrer Nutzung auf visuelle Sauberkeit geprüft werden1.
Das macht natürlich Sinn, aber nicht viele sind sich zu 100 % der Bedeutung einer visuelle Reinigung in Standardarbeitsabläufen bewusst, und wie diese für die Reinigungsvalidierung zu dokumentieren ist. Die am häufigsten gestellten Fragen sind unter anderem:
- Wie sehen Rückstände aus?
- Wo liegt die visuelle Schwelle?
- Wie beeinträchtigt das Material der Herstellung die Sichtbarkeit?
- Wie häufig muss ein Inspektor sein Sehvermögen prüfen lassen?
Nachfolgend finden Sie eine kurze Besprechung dieser Themen.
Wie sehen Rückstände aus?
Ihre Inspektoren müssen wissen, worauf sie bei der Inspektion von Ausrüstung achten müssen. Sie sollten in der Lage sein, Prozessrückstände und Rückstände von Reinigungs- und Desinfektionsmitteln zu unterscheiden und wie geringe Mengen jeder Art von Rückstand aussehen würden. Darüber müssen die Inspektoren wissen, wie die optisch saubere Oberfläche aussieht, einschließlich der Färbung von Stahl, Kratzern oder anderen Schäden, die den nächsten Produktionsschritt nicht beeinträchtigen.
Beispielsweise sehen aktive pharmazeutische Wirkstoffe (API) häufig wie Pulver aus, und Rückstände von Reinigungsmitteln können wie Flecken auf der Oberfläche aussehen.

API-Rückstände sehen häufig wie Pulver aus.

Rückstände von Reinigungsmitteln sehen häufig wie Flecken aus.
Rückstände von Reinigungsmitteln entgehen oftmals den für visuelle Sauberkeit zuständigen Inspektoren. Pharmahersteller, die für Lebensmittel- und Getränkeanwendungen konzipierte Reinigungsmittel verwenden, sollten sich darüber bewusst sein, dass Rückstände von nicht wasserlöslichen Inhaltsstoffen wie Korrosionsinhibitoren oder spezifischen Tensiden zurückbleiben können. Diese haben möglicherweise unerwartete Wechselwirkungen mit Rückständen von APIs und gehen mit in das nachfolgend hergestellte Produkt ein.
Wie beeinträchtigt das Material der Herstellung das Erscheinungsbild?
Rückstände können je nach dem in der Herstellung verwendeten Material ein anderes Erscheinungsbild haben. Ungefähr 90 % des in der pharmazeutischen Herstellung verwendeten Equipments besteht aus Edelstahl. Die restlichen Materialien sind größtenteils Glas, Gummi und Polymere wie Teflon und EPDM.
Bei der Auswahl des Equipments und der Ausbildung der Inspektoren sollte berücksichtigt werden, dass die Erkennung von Rückständen auf Polymeroberflächen schwieriger ist als auf Edelstahl.
Allerdings können und werden sich Geräte aus Edelstahl, die hoher Hitze ausgesetzt sind, mit der Zeit verfärben. Dies macht es im Laufe der Zeit schwieriger, Rückstände zu identifizieren. Alle Geräteoberflächen, die Kratzer aufweisen, müssen (wenn möglich) nachpoliert oder ersetzt werden, falls eine visuelle Sauberkeit nicht mehr mit Gewissheit zu überprüfen ist.

Die Inspektoren müssen darin geschult werden, alle Arten von Rückständen auf jeder Oberfläche sicher zu erkennen.

Das Aussehen der Rückstände kann durch unterschiedliche Verarbeitungen von Materialien beeinflusst werden (Edelstahl zu Teflon oder neu/poliert zu verfärbtem Edelstahl).
Wo liegt die visuelle Schwelle?
Die visuelle Schwelle ist die Konzentration bzw. Menge eines Wirkstoffs oder Rückstands, ab dem er sichtbar wird. Die Hersteller müssen den visuellen Schwellenwert für jeden Wirkstoff oder Rückstand bestimmen und ihn dann mit dem Niveau vergleichen, bei dem dieser Wirkstoff oder Rückstand toxikologisch signifikant wird. Falls der visuelle Schwellenwert niedriger ist als der von Ihnen bestimmte toxikologisch signifikante Wert für diesen Wirkstoff oder Rückstand, dann ist die visuelle Sauberkeit ein gültiges Maß.
Die nachstehende Analyse zeigt die Konzentration, bei der Paracetamol (ein Wirkstoff mit relativ geringem Risiko) sichtbar wird.
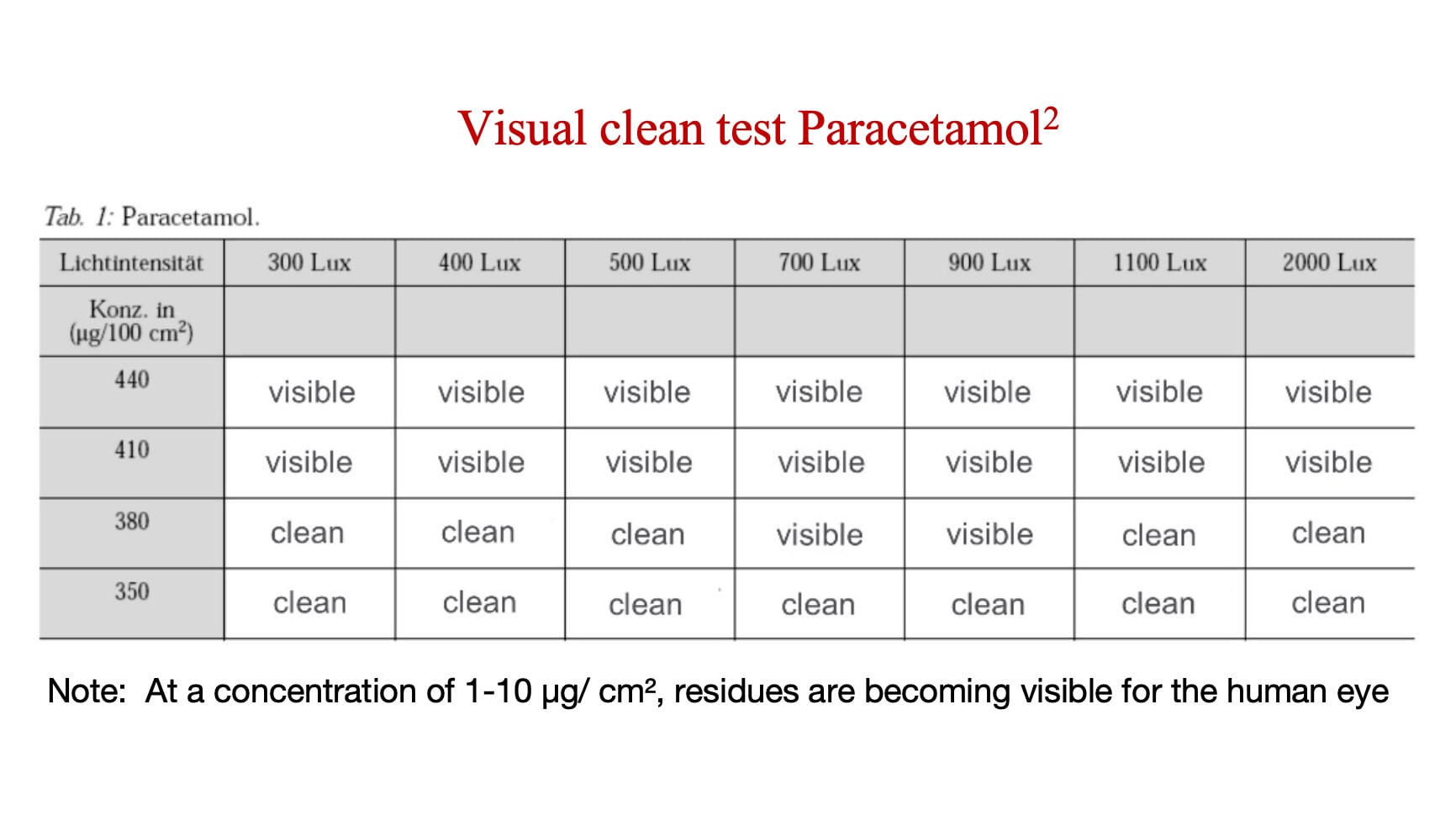
Wie häufig muss ein Inspektor sein Sehvermögen prüfen lassen?
Auch hier sind die Richtlinien nicht spezifisch. Viele Unternehmen verlangen nun, dass alle Mitarbeiter, die visuelle Inspektionen durchführen, alljährlich einer Augenuntersuchung unterzogen werden müssen.
Dies ist nicht gesetzlich vorgeschrieben. Sollten jedoch Ihre Reinigungsabläufe in Frage gestellt werden, dann kann eine Dokumentation über die gründliche Schulung und regelmäßige Sehtests Ihrer Inspektoren dazu beitragen, Aufsichtsbehörden davon zu überzeugen, dass Sie alles Angemessene getan haben.
Weitere Fragen?
Wenn Sie weitere Informationen über Best Practices und Richtlinien zur visuellen Sauberkeit haben, dann kontaktieren Sie Ecolab Life Sciences. Wir sind an pharmazeutischen Standorten auf der ganzen Welt vertreten und können Einblicke geben, wie andere Hersteller die visuelle Sauberkeit in ihre Validierungsprogramme für die Reinigung implementiert haben.
1FDA – 21 CFR Teil 211.67 erforderlich in Punkt (6) Prüfung der Geräte auf Sauberkeit unmittelbar vor der Verwendung
2Pharm. Ind. 62, Nr. 6 (2000) Buscalferri et al. – Reinigungsvalidierung


